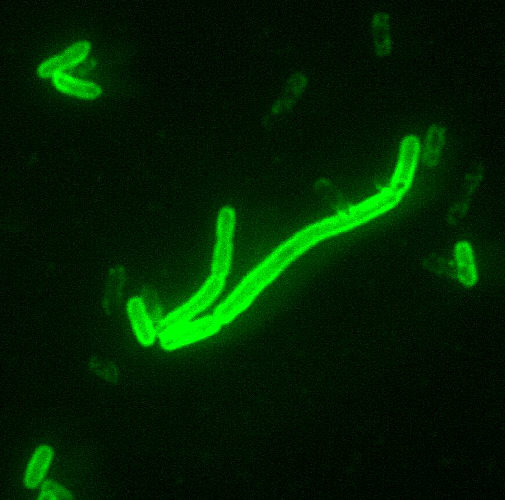
Das Bakterium Yersinia pestis1.1 NamensgebungDas Pestbakterium Yersinia pestis wurde nach dem Mediziner Alexandre YERSIN benannt. Alexandre YERSIN wurde am 22.09.1863 in Lavaux, einer Stadt in der französischen Schweiz, geboren. Er begann 1884 in Marburg Medizin zu studieren. Zwischenzeitlich arbeitete er als Präparator. Bei seiner Arbeit lernte er einen engen Mitarbeiter Luis PASTEURs namens ROUX kennen. Mit ihm entdeckte er das Diphterietoxin. 1888 belegte er am Robert Koch Institut in Berlin einen Kurs im Fach Bakteriologie. Von 1890 bis 1891 war er Schiffsarzt bei der Handelsmarine. Außerdem unternahm er Forschungsreisen ins unerschlossene Hinterland, bis er schließlich mit der Untersuchung der Pestepidemie in China um 1894 beauftragt wurde. Innerhalb von drei Wochen erkannte er, dass in den Beulen der Pestleichen der Erreger sitzt und entdeckte das später nach ihm benannte Bakterium Yersinia pestis. Außerdem beschrieb er die wesentlichen Eigenschaften des Pestbakteriums. Er identifizierte die Ratte als den Überträger des Bakteriums und somit der Seuche. Damit erreichte er den medizinischen Durchbruch. 1.2 KlassifizierungDer Genus Yersinia wird der Familie Enterobacteriaceae zugeordnet. Die wichtigen pathogenen Arten sind Yersinia pestis, Yersinia enterocolitica und Yersinia pseudotubercolosis. Die letzten zwei genannten sind Erreger der Pseudotuberkolose und Yersinia pestis verursacht die Pest. Weitere Vertreter wie Y. kristensenii, Y. bercovieri, Y. frederiksenii, Y. mollaretii und Y. intermedia spielen nur eine untergeordnete Rolle. Yersinia ruckeri ist bekannt als Erreger der Rotmaulseuche. Yersinien sind anaerob bis fakultativ anaerob. Ihre Zellen sind meistens kokkobazillär und färben sich gramnegativ. Außerdem können sie pleomorph sein. Die Differenzierungsmerkmale der Yersinien werden in Tab. 2 (siehe Bilder → Tabellen) ersichtlich. Sehr eng miteinander verwandt sind Y. pestis und Y. pseudotuberculosis. Wahrscheinlich ist Y. pestis vor nur ca. 1500 – 20.000 Jahren aus Y. pseudotuberculosis hervorgegangen. Die Verwandtschaft wird im Stammbaum deutlich (siehe Bilder → Tabellen). 1.2.1 Differenzierung nach BiovarenDas Bakterium Y. pestis wird in vier Biovare unterteilt. Diese sind Antiqua, Orientalis und Mediaevalis. Erst vor kurzem wurde das Biovar Microtus gefunden. Die ersten drei werden durch die Fähigkeit zur Nitratreduktion, Glycerolvergärung und Ammoniakproduktion differenziert (siehe Bilder → Tabellen). Microtus unterscheidet sich besonders durch die fehlende Pathogenität. Jeder der pathogenen Biovare wird einer großen Pandemie zugeordnet. Antiqua ist vor allem in Afrika zu finden. Dieser Biovar gilt als Auslöser für die Justinianische Pest. Der „Schwarze Tod“ gehört zum Biovar Mediaevalis und ist in Zentralasien lokalisiert. Orientalis löste die moderne Pest aus und ist am weitesten verbreitet. 1.3 Morphologischer AufbauYersinia pestis ist ein kurzes, plumpes, unbegeißeltes und dadurch unbewegliches Stäbchenbakterium. Ab 37°C ist es von einer Kapsel umgeben. Es ist 0,5 bis 0,8 Mikrometer breit und 1-1,3 Mikrometer lang.
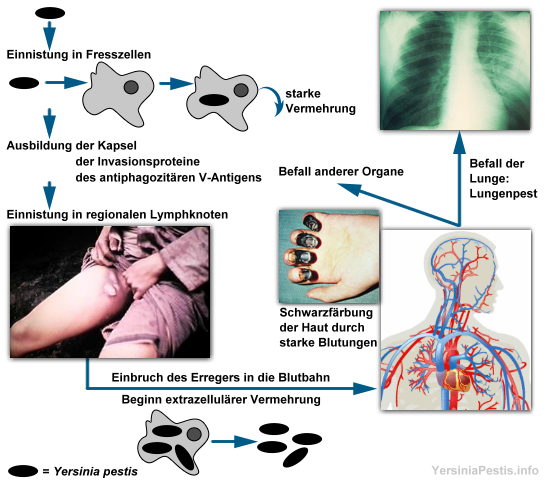
1.4 Pathogenitätsmechanismus1.4.1 Entstehung und Verlauf der KrankheitDie Pest ist hauptsächlich eine Zoonose der verschiedenen Nagetierarten. Die direkte Infektion erfolgt meist perkutan durch einen Flohbiss, wobei hier der Rattenfloh (Xenopsylla cheopsis) die vorwiegende Rolle spielt. Daher wird der Fokus der Pestübertragung hier auf Ektoparasiten gerichtet. Außerdem kann man durch Einatmen der Bakterien infiziert werden. Nachdem der Floh das Blut eines infizierten Tieres in seinen Vormagen aufgenommen hat, vermehrt sich das Yersinia-Bakterium dort um ein Vielfaches. Beim erneuten Biss des Flohs erbricht er eine große Menge der Bakterien in die Bisswunde des Opfers. Da Yersinia pestis ein fakultativ intrazelluläres Bakterium ist, ist es in der Lage sich sowohl intrazellulär als auch extrazellulär zu vermehren. Durch bestimmte Proteine kann sich die Pest in Wirtszellen einnisten. Dies bringt dem Pestbakterium wichtige Vorteile. Es ermöglicht eine weite Verbreitung auch in tieferen Geweben, da Zellbarrieren überwunden werden. Meist haben die Bakterien dadurch auch ein nährstoffreiches Habitat und daher bessere Wachstumsbedingungen. Doch auch der Schutzfaktor ist wichtig. Denn in den Zellen haben die Pestbakterien einen Teilschutz vor Antibiotika und sind weitgehend vor Antikörpern und Phagozyten geschützt. Für Y. pestis ist die intrazelluläre Vermehrung jedoch zusätzlich die Voraussetzung alle Virulenzfaktoren zu bilden, die bei der primären Infektion des menschlichen Organismus noch nicht vorhanden sind. Sind antiphagozytäre Pathogene noch nicht exprimiert, wird ein Großteil der Bakterien sofort nach der Injektion durch Granulozyten vernichtet. Daher beginnt Y. pestis sofort mit der Invasion von nicht aktivierten Fresszellen und Epithelzellen, um sich dort unter Bläschen- und Pustelbildung zu vermehren. Hier wird nun die Virulenz bei 37°C voll entfaltet. Es bildet sich eine schützende Kapsel und Invasionsproteine. Anschließend gelangen die Bakterien vom Lymphsystem in die lokalen Lymphknoten. Diese schwellen aufgrund von vermehrter Leukozytenbildung an, entzünden sich und eitern. Die Vermehrung wird nun durch die Virulenzfaktoren, welche die Abwehrkräfte der Zellen senken, stark vorangetrieben. Wenn die Lymphknoten mit den Pestbakterien überlastet werden, bricht die Abwehrbarriere zusammen. Bald darauf kommt es zum Einbruch der Bakterien in die Blutbahn. Daraus resultiert eine Sepsis. Nach und nach werden alle Organe befallen. Durch die Streuung im Blut gelangt das Bakterium in den kleinen Blutkreislauf und somit in die Lunge. Eine Lungenpest ist die Folge. Durch eine Entzündung der Bronchien (Bronchitis) versucht der Körper das Bakterium abzuwehren. Doch schnell werden weitere Teile der Lunge befallen, was zur Lungenentzündung und Atemnot führt. In diesem späteren Stadium vermehren sich immer mehr Bakterien extrazellulär. Bei hoher Erregerkonzentration im Blut kommt es zu Verklumpungen. Aufgrund dieser stark ablaufenden Blutgerinnung werden immer mehr Gerinnungsfaktoren (z.B. Fibrinogen) verbraucht. Y. pestis jedoch löst das Fibrinogen mithilfe des Plasminogen-Aktivator-Proteins und versucht so die Verklumpung des Blutes zu verringern. Da aufgrund der erhöhten Ausschüttung nun nur noch wenige Gerinnungsfaktoren vorhanden sind, kann der Körper immer schlechter Blutungen stillen und zeigt eine starke Bereitschaft für Blutungen. Dies verursacht ein schweres Krankheitsbild mit Hämorrhagien auf der Haut und in den Organen und stellt eine lebensbedrohliche Situation dar. Im Endstadium ist das Herz nicht mehr in der Lage genügend Blut in den Körper zu pumpen. Die Folgen sind Herzschwäche, Kreislaufversagen und letztendlich der Tod des Wirts.
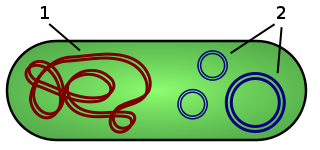
1.4.2 VirulenzfaktorenDas Pestbakterium kann 3 Plasmide besitzen, die verschiedene Virulenzgene tragen. Im Gegensatz zur chromosomalen Genkodierung stellt die Plasmidkodierung eine eigenständige Erbinformation unabhängig vom Chromosom der Plasmide dar.
Einige Plasmide können sich jedoch in das Chromosom einbauen und zwischen den Bakterien ausgetauscht werden. Plasmide sind ringförmige DNA-Moleküle, die in einer Bakterienzelle neben der chromosomalen DNA vorhanden sein können. Sie können sich unabhängig von der chromosomalen DNA duplizieren und enthalten Gene, welche dem Bakterium selektive Vorteile wie z.B. Impfstoffresistenz verschaffen können. Bakterien ohne Plasmid haben daher eine sehr viel geringere Virulenz und können leichter vom Immunsystem besiegt werden. Das wichtigste Plasmid ist das pYV (plasmid for Yersinia Virulenz [70 Kilobasen]), da es essentiell für die anhaltende Vermehrung im Wirtsgewebe ist. Es kodiert das „Typ-III-Sekretionssystem“, „Yops“ (Yersinia outer proteins) und das „V-Antigen“. Außerdem gibt es noch zwei für Y. pestis spezifische Plasmide (pMT1 [101kb]und pPCP1 [9,6kb]), die ebenfalls die Virulenz vergrößern und eine höhere Durchlässigkeit durch Zellbarrieren ermöglichen. Die meisten Virulenzgene von Y. pestis sind in Plasmiden kodiert. 1.4.2.1 Kapsel (Fraktion 1)Diese Kapsel, die aus einem Fraktion 1(F1) Protein besteht, wird bei 37°C und somit erst im Wirt ausgebildet. Bei der optimalen Vermehrungstemperatur von Y. pestis bei 28°C ist sie noch nicht ausgebildet. Sie ist immunogen. Die Aufgabe der Kapsel ist es, die Resistenz des Bakteriums gegen Phagozytose, also gegen die Aufnahme durch Makrophagen und Granulozyten zu erhöhen. 1.4.2.2 Typ-III-Sekretionssystem (TTSS)Das Typ-III-Sekretionssystem (TTSS= type three secretions system) ist ein sehr wichtiger Faktor für die Virulenz von Yersinia pestis. Es ist ein Injektionsapparat, der einer Art hohlen Nadel gleicht. Durch diese Nadel, die aus Eiweißen aufgebaut ist, werden Giftstoffe wie die Yops in die Fress- bzw. Wirtszelle abgegeben. Dadurch werden die Zellen getötet und bieten nun einen Nährboden für die eigene Vermehrung. Diese Nadel ist nur 60 Millionstel Millimeter groß und ragt aus dem Bakterium heraus. 1.4.2.3 Yops (Yersinia outer proteins)Ebenfalls erst bei 37°C werden die Invasionsproteine von Y. pestis, die Yops gebildet. Nachdem sie durch das TTSS ausgesandt wurden, werden einige Yops direkt in die Fresszellen abgegeben. Dort blockieren sie die Phagozytose und die Produktion von entzündungsfördernden Gewebshormonen. Somit wird die Entzündung, welche eine natürliche Abwehrreaktion des Körpers ist, verhindert. Außerdem bewirken die Yops den programmierten Zelltod, die Apoptose, der Fresszellen. Y. pestis gelangt durch Bildung der Yops an Wirtszell-Rezeptoren in engen Kontakt mit der Wirtszelle. Durch kontinuierliche Ausbreitung der Wirtszelle stülpt sich die Wirtszellplasmamembran um das Bakterium, bis dieses ganz aufgenommen ist. Dieses Eindringen in die Wirtszelle wird als Zipper-Mechanismus bezeichnet. 1.4.2.4 Plasminogen-Aktivator Protein (Pla)Dieses Protein ist ein extrazelluläres Produkt von Y. pestis. Es spielt eine wichtige Rolle bei der generalisierten Ausbreitung (im ganzen Körper) des Bakteriums. Es wirkt außerdem fibrinolytisch. Die Synthese des Pla ist nicht temperaturabhängig, aber bei 37°C wirkt es stärker fibrinolytisch als bei 28°C. 1.4.2.5 V-Antigen (LcrV)Auch das V-Antigen wird bei 37°C ausgebildet. Es wird in extrazelluläre Gebiete abgegeben, wo es wie die Yops Entzündungen blockiert. Es wirkt antiphagozytär. Außerdem bildet dieses Protein die Struktur der Spitze des Typ-III-Sekretionssystems. Antikörper gegen das V-Antigen bieten daher einen gewissen Schutz gegen das Pestbakterium. 1.4.2.6 W-AntigenDieses Antigen ist ein Endotoxin. Endotoxine werden erst nach dem Absterben der Bakterien freigesetzt. Ihre toxische Wirkung ruft Fieber bis hin zum septischen Schock hervor. Es werden Entzündungen in Abwehrzellen oder deren Zelltod hervorgerufen. Dieses Toxin soll die Immunabwehr des Opfers schwächen, um bessere Bedingungen für nachkommende Pestbakterien zu schaffen. 1.4.2.7 YersiniabactinDas Yersiniabactin ist im Gegensatz zu vielen anderen Virulenzgenen chromosomal und nicht in einem Plasmid kodiert. Es bildet ein Eisentransportsystem. Dieses Eisentransport- und aufnahmesystem stellt einen essentiellen Virulenzfaktor aller Yersinien dar, weil Eisen für zahlreiche Redoxprozesse beim Wachstum in der Zelle benötigt wird. Deshalb ist eine effektive Eisenaufnahme für die Pathogenität von großer Bedeutung. Im menschlichen Organismus ist die Konzentration an freiem Eisen jedoch äußerst gering. Außerdem nehmen Leukozyten in infiziertem Gewebe zusätzlich das Transportprotein Laktoferrin, an dem Eisen extrazellulär gebunden ist, auf und halten die Eisenkonzentration so gering. Wenn zu wenig Eisen vorhanden ist, scheiden pathogene Yersinia-Spezies, so auch Yersinia pestis, Eisenchelatoren, so genannte Siderophore, aus. Siderophore sind Stoffe die Eisen, zu dem sie eine hohe Affinität haben, binden und zu dessen Transport dienen. Siderophore können sowohl bakterielle Membrane als auch Membranen höherer Zellen überwinden und somit das gebundene Eisen gezielter in das Zellinnere transportieren. 1.4.2.8 „Mausletales Toxin“Das „Mausletale Toxin“ ist ein an die Zelle gebundenes Protein, welches toxisch für Mäuse und Ratten ist. Es ist jedoch, selbst in großen Dosen, nicht toxisch für Meerschweinchen, Hasen, Hunde oder Primaten. Es führt zum Kreislaufkollaps und wird erst nach dem Absterben des Bakteriums abgegeben. Außerdem schützt es Y. pestis im Darm von Flöhen, indem es eine für Zellgifte undurchdringliche Membran bildet.
|
|
▲ Seitenanfang | Quellen Kontakt Impressum | design+copyright 2009 Stephan Riesenberg |